【13485】醫療器械質量管理體系認證
發布日期:2022-10-11 瀏覽次數:0次
ISO13485標準是適用于醫療器械法規環境下的質量管理體系標準,其全稱是《醫療器械 質量管理體系 用于法規的要求》。ISO13485認證主要涉及的組織類型包括:醫療器械設計和制造商、醫療器械經營商、醫療器械服務提供方、醫療器械軟硬件開發商以及醫療器械零部件/材料供應商。
ISO13485認證介紹
ISO13485標準是適用于醫療器械法規環境下的質量管理體系標準,其全稱是《醫療器械 質量管理體系 用于法規的要求》。它采用了基于iso9001標準中PDCA的相關理念,相較iso9001標準適用于所有類型的組織,ISO13485更具有專業性,重點針對與醫療器械設計開發、生產、貯存和流通、安裝、服務和最終停用及處置等相關行業的組織。目前組織可以依據ISO13485:2016版標準建立體系或者尋求認證。
ISO13485:2016標準重點內容
本標準以法規要求為主線,強化了企業滿足法規要求的主體責任;
本標準強調基于風險的方法管理過程,強化組織應將基于風險的方法應用于控制質量管理體系所需的適當過程;
本標準在ISO9001的基礎上,更加強調形成文件的要求和記錄的要求。
適用企業類型
ISO13485認證主要涉及的組織類型包括:醫療器械設計和制造商、醫療器械經營商、醫療器械服務提供方、醫療器械軟硬件開發商以及醫療器械零部件/材料供應商。
ISO13485認證涉及的相關產品分為7個技術領域
1、非有源醫療設備
2、有源(非植入)醫療器械
3、有源(植入)醫療器械
4、體外診斷醫療器械
5、對醫療器械的滅菌方法
6、包含/使用特定物質/技術的醫療器械
7、醫療器械有關服務
分類小知識 :13485認證技術領域的分類方法來源于IAF MD9: 2017 《ISO/IEC 17021在醫療器械質量管理體系領域(ISO13485)的應用》,其分類方法與國內分類方法略有不同,該分類方法暨包括了醫療器械也包括了與醫療器械有關的活動,如對醫療器械的滅菌及有關服務。其中對醫療器械的滅菌方法,包括環氧乙烷滅菌、輻照滅菌、濕熱滅菌等;醫療器械有關服務包括,醫療器械有關的原材料、部件、組件、校準、分銷、維修、配送等。

ISO13485認證申請的條件
一、申請人應具有明確的法律地位
二、申請人應具備相應的許可資質
1、 對于生產型企業,I類產品需提供醫療器械產品備案憑證以及生產備案憑證;II類及III類產品需提供醫療器械產品注冊證和醫療器械生產企業許可證;
2、對于經營企業,經營II類產品的需要提供醫療器械經營企業備案憑證;經營III類產品的需要提供醫療器械經營企業許可證;
3、對于僅出口的企業,根據3月31日商務部、海關及藥監局三部委的文件,出口醫療防疫物品在滿足進口國要求的前提下還需要取得國內醫療器械產品注冊證/備案憑證以及醫療器械生產企業許可證/備案憑證;
三、申請人已經按照標準建立文件化的管理體系(包括質量手冊、程序文件、內審資料、管理評審資料以及程序文件要求的其它相關表單)
四、認證申請前,受審核方的管理體系原則上至少有效運行三個月并進行了一次完整的內部審核和管理評審(對于生產植入性醫療器械產品,體系運行時間至少6個月,其他產品的管理體系至少運行3個月。
ISO13485認證流程
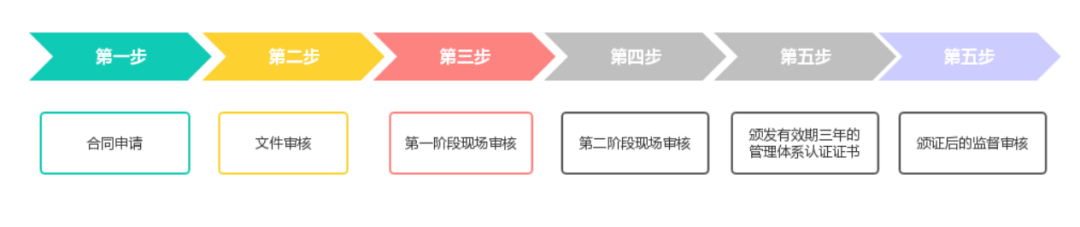
初次審核:
1、企業將填寫好的《ISO13485認證分申請表》,認證中心收到申請認證材料后,會對文件進行初審,符合要求后發放《受理通知書》。
2、現場檢查一周前將檢查組組成和檢查計劃正式報企業確認。
3、現場檢查按環境標志產品保障措施指南的要求和相對應的環境標志產品認證技術要求進行。
4、檢查組根據企業申請材料、現場檢查情況、產品環境行為檢驗報告撰寫環境標志產品綜合評價報告,提交技術委員會審查。
5、認證中心收到技術委員會審查意見后,匯總審查意見。
6、認證中心向認證合格企業頒發環境標志認證證書,組織公告和宣傳。
7、獲證企業如需標識,可向認證中心訂購;如有特殊印制要求,應向認證中心提出申請并備案。
8、年度監督審核每年一次。
監督審核:
1、認證中心根據企業認證證書發放時間,制訂年檢計劃,提前向企業下發年檢通知。企業按合同要求繳納年度監督管理費,認證中心組成檢查組,到企業進行現場檢查工作。
2、現場檢查時,對需要進行檢驗的產品,由檢查組負責對申請認證的產品進行抽樣并封樣,送指定的檢驗機構檢驗。
3、檢查組根據企業材料、檢查報告、產品檢驗報告撰寫綜合評價報告,報認證中心總經理批準。
4、年度監督檢查每年一次。
認證準備:

ISO13485認證意義
01、體現組織對于履行相關法律法規的承諾
02、幫助組織提升自身的管理水平和運行績效,向公眾和監管機構傳遞信心
03、標準中強調了風險管理的要求,幫助組織通過有效的風險管理,降低組織出現質量事故或不良事件的風險概率。
相關文章推薦
2022ISO37301加分資質證書排行榜之ISO三體系認證 一公司在某寶網購ISO體系證書被查處,沒收并批評警告! 服務認證,ISO27922售后服務認證基本常識簡介 ISO37301認證 合規管理體系ISO37301認證的好處 多家企業涉嫌非法買賣iso認證證書將被列入嚴重違法失信名單,你的證書“踩坑”了嗎? 建設GB/T 31950-2015企業誠信管理體系,樹立信譽之基 ISO26000認證 責任品牌與品牌的責任競爭力 iso27017認證多少錢 ISO認證 | 什么是ISO體系認證?關于企業申請三體系認證的好處! ISO13485醫療器械法質量管理體系認證,這些巨頭企業也很關注!
